Cos’è un trial clinico?
Un trial clinico, noto anche come studio clinico o sperimentazione clinica, in medicina è una fase della ricerca scientifica condotta su esseri umani per valutare l’efficacia e la sicurezza di un nuovo intervento sanitario, che può essere una molecola, potenziale farmaco, un trattamento, un dispositivo medico o una strategia di intervento.
I trial clinici sono una componente fondamentale della ricerca medica e svolgono un ruolo cruciale nello sviluppo di nuovi trattamenti efficaci e sicuri.
In questo articolo vogliamo descrivere in modo completo le diverse fasi di un trial clinico, dalla fase pre-clinica alla fase 4, evidenziandone gli obiettivi e la rigorosità scientifica nonché la tutela dei partecipanti.
A cosa servono i trial clinici?
I trial clinici sono fondamentali per il progresso medico in quanto forniscono prove scientifiche rigorose per determinare se una nuova cura sperimentale è:
-
- Sicura: non provoca effetti collaterali gravi o dannosi.
- Efficace: funziona nel trattamento o nella prevenzione della malattia in questione.
- Migliore: rappresenta un progresso rispetto ai trattamenti standard già esistenti.
I trials clinici si svolgono seguendo protocolli di ricerca rigorosi per garantire la validità dei risultati e la tutela dei partecipanti.
Come funziona la sperimentazione di un farmaco?
La sperimentazione clinica è un processo lungo che prevede due macrofasi: la fase pre-clinica e la sperimentazione clinica della molecola, ovvero del potenziale farmaco, sugli uomini.
Durante la fase preclinica che avviene in laboratorio, vengono svolti studi in vitro, ad esempio su colture cellulari e studi su modelli murini ossia animali come topi, ratti e conigli.
In questo studio i ricercatori valutano:
-
- Come funziona la molecola o la terapia: viene studiato il meccanismo d’azione e il suo impatto sulla malattia.
- Qual è la dose efficace: si determina la quantità necessaria per ottenere l’effetto desiderato, minimizzando i potenziali effetti collaterali.
- Se la molecola è sicura: si valutano eventuali tossicità o altri rischi associati alla terapia.
- Se è stabile: si verificano la stabilità chimica e la formulazione ottimale per la somministrazione.
Quanto dura la fase pre-clinica?
In media, tra i 3 e i 5 anni, ma può variare a seconda della complessità della terapia. Purtroppo, solo meno del 50% delle molecole testate in questa fase supera il vaglio e passa alla sperimentazione sull’uomo.
Quali sono le fasi di sperimentazione di un farmaco?
Lo studio clinico o sperimentazione clinica è suddivisa in 4 fasi, ognuna con obiettivi specifici.
La fase 1 viene condotta generalmente su volontari sani. Essa dura circa 1-2 anni.
L’obiettivo della fase 1 è valutare la sicurezza e la tollerabilità della molecola negli individui.
Attraverso uno studio di coorte, vengono arruolati un numero limitato di volontari sani in pochi centri selezionati.
La somministrazione della molecola inizia con frazioni minime della dose utilizzata sugli animali, aumentandola gradualmente fino a raggiungere la dose massima tollerabile (DMT) nell’uomo.
In questo modo sarà possibile valutare gli eventuali effetti collaterali e in che modo la molecola si distribuisce nel corpo umano e come viene eliminata.
Se il farmaco dimostra di avere un livello di tossicità basso può passare alle successive fasi della sperimentazione con il via libera del Ministero della Salute e dagli enti regolatori.
Dopo aver superato i rigorosi test di sicurezza della fase 1, si entra nella fase 2, un passo cruciale nel suo percorso verso l’applicazione della cura sperimentale sui pazienti. Questa fase, che dura circa due anni, rappresenta la prima volta in cui la molecola viene somministrata a persone affette dalla malattia per cui è stata sviluppata.
L’obiettivo principale della fase 2 è continuare a studiare la sicurezza del nuovo farmaco, valutandone al contempo l’efficacia, ovvero la sua capacità di produrre gli effetti curativi desiderati nell’uomo.
Rispetto alla fase 1, la fase 2 coinvolge un numero maggiore di pazienti, questo permette di raccogliere dati più precisi sull’efficacia e la sicurezza del trattamento.
Due Modalità di studio clinico
Gli studi di fase 2 possono essere condotti in due modalità:
-
- Aperti: i pazienti sono accuratamente selezionati e ricevono il trattamento in modo aperto, senza che né loro né i medici sappiano se stanno assumendo la molecola effettiva o il placebo.
- Controllati in doppio cieco: sia i pazienti che i medici non sanno chi stia assumendo la molecola effettiva o il placebo fino alla fine dello studio. Questo metodo garantisce la massima obiettività dei risultati.
I risultati della fase 2 vengono presentati alle autorità sanitarie per l’approvazione del farmaco. È in questa fase che si decide se il trattamento ha dimostrato sufficiente efficacia e sicurezza per essere commercializzato.
Tuttavia, per alcuni farmaci con un elevato potenziale curativo ma destinati a un numero limitato di pazienti con malattie rare (i cosiddetti “farmaci orfani”), esiste il rischio di un blocco della commercializzazione.
Dopo aver superato con successo le prime due fasi, il nuovo trattamento entra nella fase 3, la tappa cruciale che ne determina il destino. In questa fase, su larga scala, si verifica la sicurezza e l’efficacia del farmaco su una coorte più ampia di pazienti, selezionati con criteri rigorosi per rappresentare al meglio la popolazione di pazienti affetti dalla specifica malattia.
L’obiettivo primario della fase 3 è confermare l’efficacia del farmaco, dimostrando che funziona meglio o almeno altrettanto bene rispetto ai farmaci già in commercio. Per fare questo, i pazienti vengono suddivisi in due gruppi:
-
- Gruppo di trattamento che riceve il nuovo farmaco.
- Gruppo di controllo che riceve un placebo o un altro farmaco già approvato per la stessa malattia.
Oltre all’efficacia, la fase 3 valuta attentamente la sicurezza del trattamento, monitorando con scrupolo l’insorgenza e la gravità di eventuali effetti collaterali. Questa osservazione può durare fino a 5 anni, garantendo una valutazione completa e a lungo termine degli effetti del farmaco.
Se la fase 3 supera brillantemente tutti i test, dimostrando un profilo di efficacia e sicurezza soddisfacente, il percorso verso l’approvazione si avvicina. I dati di tutte le fasi di sperimentazione, preclinica e clinica, vengono presentati all’Agenzia Italiana del Farmaco (AIFA), l’autorità competente che valuterà se concedere o meno l’autorizzazione alla commercializzazione del farmaco.
La fase 3 rappresenta il momento più esteso e rigoroso dell’intero processo di sviluppo di un nuovo farmaco. La sperimentazione viene condotta in più centri, spesso a livello internazionale, garantendo la massima affidabilità dei risultati.
Per evitare che le aspettative o le convinzioni dei partecipanti influenzino i risultati, la fase 3 impiega diverse strategie:
-
-
- studio randomizzato: i pazienti vengono assegnati ai gruppi di trattamento o controllo in modo casuale, eliminando qualsiasi distorsione.
- studio in cieco o doppio cieco: Né i pazienti né i ricercatori sanno chi sta assumendo il farmaco effettivo e chi il placebo, garantendo un’obiettività assoluta.
-
La fase 3 rappresenta un passo fondamentale nel cammino verso la cura perché apre la porta all’immissione in commercio del farmaco, con l’obiettivo finale di migliorare la salute e la qualità di vita dei pazienti.
Una volta messo in commercio, il farmaco entra in fase 4 che include gli studi sperimentali e osservazionali per la farmacovigilanza. Durante questa fase che prevede lunghi periodi di somministrazione si osserva se si verificano reazioni indesiderate e impreviste. La somministrazione avviene in un numero sempre maggiore di individui. Questi studi possono inoltre aiutare i ricercatori a comprendere meglio l’uso di un farmaco per le applicazioni approvate.
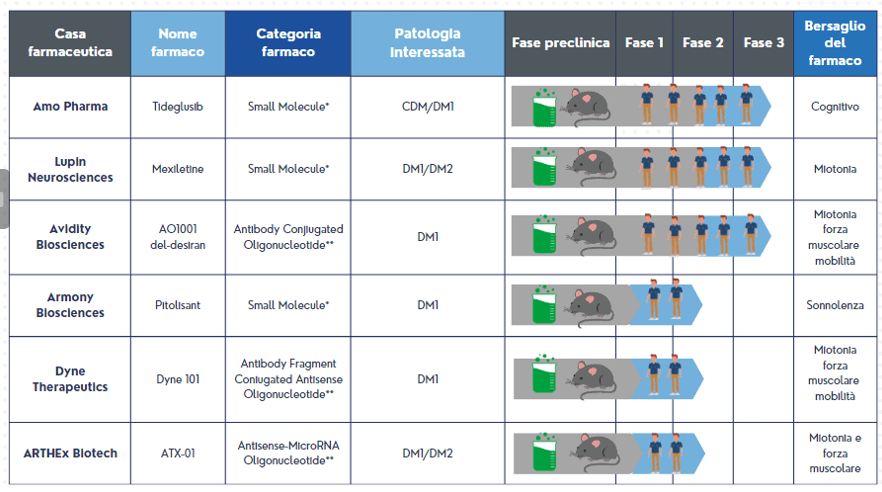
I trial clinici in corso sulle Distrofie Miotoniche e relative fasi della sperimentazione
Il grafico che segue vuole dare una fotografia immediata dello stato avanzamento lavori sui trials clinici in corso. Attraverso l’utilizzo di figure/immagini, abbiamo cercato di spiegare in modo esplicito e figurato la differenza tra le varie fasi della ricerca in termini di tipologia di studi, dallo studio in vitro all’osservazione sull’uomo, con indicazione del relativo bersaglio terapeutico.
Nel grafico vengono presi in considerazione i trials clinici più importanti e che si trovano nel percorso clinico in fase più avanzata.
Ricordiamo che tali trials al momento sono svolti da case farmaceutiche americane su pazienti statunitensi.
Legenda:
*Small Molecule: molecole già in commercio che vengono usate per il farmaco
** Oligonucleotide: farmaci di nuova sintesi, ad impronta genetica, che si legano a copie di DNA e RNA.
La casa farmaceutica Avidity Bioscience, che sta sperimentando il farmaco AOC-1001 nel trial Marina Olè, ha annunciato lo scorso aprile che, avendo ricevuto l’approvazione da parte dell’EMA (Agenzia regolatrice europea del farmaco), la fase 3 della sperimentazione del farmaco avverrà anche in Europa e coinvolgerà circa 44 pazienti DM1 provenienti dai Centri Europei. (Approfondisci qui)
Quando può essere avviato uno studio clinico?
L’avvio di un trial clinico è un processo complesso e articolato che richiede il superamento di diverse fasi ben definite, volte a garantire la rigorosità scientifica, la sicurezza e l’eticità della sperimentazione.
Riassumendo, le fasi chiave sono:
-
- Sviluppo del trattamento: La prima fase consiste nello sviluppo di un nuovo farmaco. Questo processo coinvolge una serie di ricerche precliniche in laboratorio e su modelli animali per valutarne l’efficacia e la sicurezza potenziale.
- Presentazione della domanda all’AIFA: Una volta ottenuti risultati preclinici promettenti, i promotori del trial (aziende farmaceutiche, università, centri di ricerca) presentano una domanda di autorizzazione alla sperimentazione clinica all’Agenzia Italiana del Farmaco (AIFA).
- Valutazione da parte dell’AIFA: L’AIFA valuta attentamente la domanda, esaminando la documentazione scientifica relativa al trattamento, il protocollo di sperimentazione, la scelta dei centri di ricerca e la tutela dei partecipanti.
- Comitato Etico Indipendente: Se la domanda supera la valutazione preliminare dell’AIFA, viene sottoposta a un Comitato Etico Indipendente (CEI). Il CEI valuta l’aspetto etico della sperimentazione, garantendo la tutela dei diritti e del benessere dei partecipanti.
- Autorizzazione e Avvio: Se sia l’AIFA che il CEI esprimono parere favorevole, viene rilasciata l’autorizzazione all’avvio del trial clinico. Il trial può quindi iniziare presso i centri di ricerca selezionati, nel rispetto del protocollo approvato.
L’avvio di un trial clinico rappresenta un momento cruciale nel percorso di sviluppo di un nuovo trattamento. Superare le rigorose fasi di valutazione e ottenere le autorizzazioni necessarie è un traguardo fondamentale per poter testare l’efficacia e la sicurezza del trattamento su pazienti reali e contribuire al progresso della medicina.
Chi sono i soggetti coinvolti nello studio clinico?
Gli studi clinici di solito comprendono una serie di stakeholders:
- Lo sponsor è l’organismo (di solito un’azienda, università o ospedale) che assume la responsabilità di organizzare lo studio e spesso finanzia la sperimentazione.
- Lo sperimentatore (o sperimentatori per studi multicentrici) – il medico responsabile per l’esecuzione della sperimentazione.
- A volte lo sponsor coinvolgerà una organizzazione di ricerca a contratto (Contact Research Organisation, CRO) che fornisca assistenza nell’ambito della logistica (organizzazione) e della conduzione della sperimentazione.
Chi può partecipare ad un trial clinico?
Possono partecipare ad un trial clinico tutti coloro che volontariamente chiedono di farne parte ma che al contempo abbiano i requisiti generici e specifici richiesti dalla tipologia di trial clinico.
La possibilità di partecipare ad un trial clinico dipende da diversi fattori, tra cui:
Requisiti Generici:
-
- Maggiore età: In generale, è necessario aver compiuto 18 anni per poter partecipare a un trial clinico.
- Condizioni di salute: I partecipanti devono essere in buone condizioni di salute e non presentare controindicazioni specifiche che potrebbero interferire con il trial o mettere a rischio la loro sicurezza.
- Caratteristiche cliniche: I partecipanti devono presentare le caratteristiche cliniche compatibili con il protocollo del trial, ovvero avere la patologia o la condizione oggetto di studio.
Criteri Specifici:
Oltre ai requisiti generici, ogni trial clinico ha criteri di inclusione ed esclusione specifici che definiscono con maggiore precisione chi può e chi non può partecipare. Questi criteri variano a seconda del tipo di studio, della patologia in oggetto e delle caratteristiche del trattamento sperimentale.
Come Vengono Selezionati i Partecipanti
Il processo di selezione dei partecipanti ai trial clinici è rigoroso e segue protocolli specifici per garantire la sicurezza e l’affidabilità dei risultati dello studio. In generale, la selezione avviene attraverso diverse fasi:
-
- Valutazione iniziale: Il potenziale partecipante viene sottoposto a una valutazione medica per verificare se soddisfa i criteri di inclusione ed esclusione del trial.
- Esami e test: Vengono effettuati esami e test diagnostici e genetici per raccogliere informazioni sulla salute del potenziale partecipante e sulla sua idoneità al trial.
- Colloquio informativo: Il potenziale partecipante riceve informazioni complete sul trial, compresi i suoi obiettivi, la procedura, i potenziali rischi e benefici, i suoi diritti e doveri.
- Firma del consenso informato: Il potenziale partecipante firma un consenso informato, un documento che attesta la sua libera e consapevole volontà di aderire al trial.
E’ Importante Sottolineare Che:
-
- La partecipazione a un trial clinico è sempre volontaria. Il potenziale partecipante ha il diritto di rifiutare o ritirarsi dal trial in qualsiasi momento.
- I partecipanti ai trial clinici hanno diritti e doveri specifici. I loro diritti includono il diritto di essere informati, il diritto di esprimere il proprio consenso e il diritto di ritirarsi dal trial. I loro doveri includono il rispetto delle regole del trial e la collaborazione con i ricercatori.
I trial clinici rappresentano un’importante opportunità per i pazienti di accedere a nuove cure promettenti e per contribuire al progresso della medicina.